2024年8月2日,华东师范大学李大力教授团队在Cell Press细胞出版社期刊Molecular Cell上发表题为“Engineering IscB to develop highly efficient miniature editing tools in mammalian cells and embryos”的研究论文。该研究综合蛋白质工程化改造、RNA结构优化、胚胎注射等技术,成功开发了基于IscB的高活性迷你基因编辑工具并率先实现了小鼠体内高效编辑。华东师范大学博士研究生薛念念,硕士研究生洪迪珊,博士后张丹以及硕士研究生王茜为本文的共同第一作者,华东师范大学李大力研究员,朱一凡、王立人副研究员为本文的共同通讯作者。
论文概述
在过去十多年里,以CRISPR/Cas9为代表的基因编辑及其衍生技术得到了快速发展,使人们能够更加精准高效的对基因进行改造,为更好地理解生命过程、开发精准的基因疗法提供了新的可能性。首个基于CRISPR/Cas9技术的离体(ex vivo)基因编辑疗法Casgevy已于2023年底获批上市,用于地贫和镰贫的基因治疗[1];通过肝脏靶向的LNP-mRNA递送的方式,在体(in vivo)基因疗法也取得了喜人的临床试验数据。基因编辑技术已经迈进了临床应用的时代。然而,靶向于肝脏以外器官的在体基因编辑治疗仍存在很大的瓶颈。目前适用于肝外基因递送的载体主要是腺相关病毒(Adeno-associated viruses, AAV),然而其包装上限约4.7kb,单个载体难以递送Cas9等核酸酶及其衍生编辑系统,因此寻找尺寸更小的基因编辑系统对于实现安全高效的体内递送具有重要意义。近年来,陆续报道了一系列小型Cas蛋白,包括小型Cas12f蛋白[2-4]、其进化上的祖先TnpB[5,6]以及真核同源物Fanzor[7,8]。然而,由于Cas12f家族只有一个RuvC结构域,难以用于碱基编辑、先导编辑等依赖于缺口酶的衍生技术。
2021年,张锋团队通过对测序数据有针对性的挖掘和分析,发现由IS200/IS605转座子超家族编码的IscB核酸酶,也具有能够切割DNA链的HNH和RuvC结构域[9]。作为Cas9可能的进化祖先,IscB普遍只有约400-500个氨基酸(仅为SpCas9氨基酸长度的三分之一左右)也利用一段非编码RNA(ωRNA)引导蛋白识别DNA。因此,IscB更有潜力构建缺口酶,与胞嘧啶脱氨酶(APOBEC)、腺苷脱氨酶(TadA)或逆转录酶(RT)融合,构建可由单个AAV完整包装的迷你碱基编辑器(BE)或先导编辑器(PE),具有极大的临床应用潜力。
然而,IscB在哺乳动物细胞中的活性非常有限。以OgeuIscB为例,其在HEK293FT细胞中编辑效率不到5%。因此,能否通过工程化的改造提高IscB的基因编辑活性,达到与Cas9相当的活性是需要解决的首要问题。
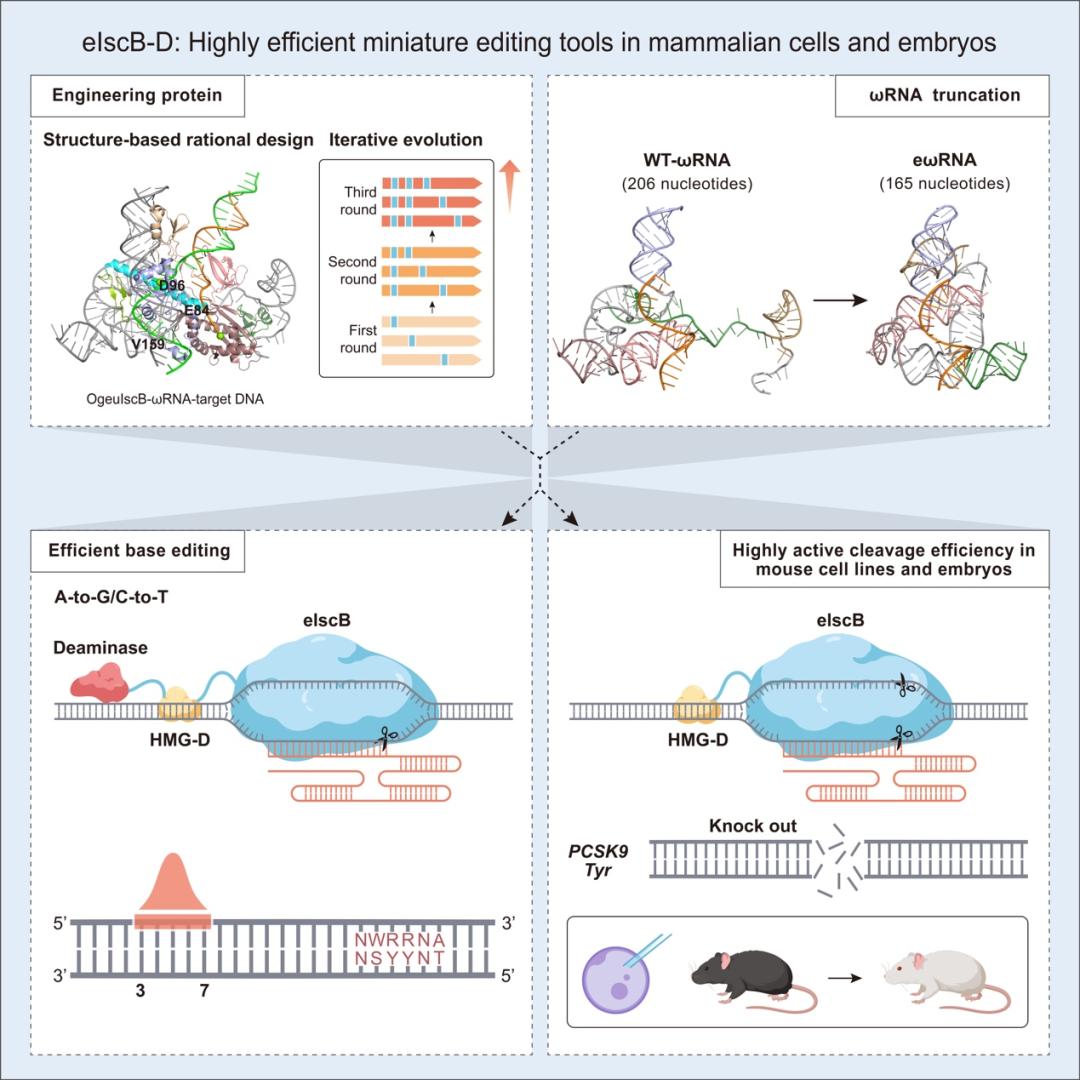
图 1 论文摘要图
研究人员首先通过蛋白质改造,基于结构理性设计在IscB蛋白关键位置引入氨基酸突变[10,11],经过三轮迭代筛选,获得了增强型IscB(命名为eIscB)。eIscB平均编辑效率相较于野生型IscB可提高7.5倍。此外,研究者通过融合一个非序列特异性双链DNA结合蛋白(HMG-D)提高IscB与目标DNA的亲和力,高活性IscB(eIscB-D)的最高编辑效率可达91.3%。
在此基础上,研究者针对向导RNA进行优化改造,获得高效ωRNA(命名为eωRNA),且长度相较于野生型ωRNA缩短了约20%,降低了工业合成的难度。最后优化获得的eIscB-D/eωRNA编辑效率相比原始IscB/ωRNA平均可提升20.2倍。
在此基础上,研究人员通过在RuvC结构域关键催化位点引入丙氨酸突变,通过筛选,开发了IscB切口酶(eIscBH339A),并与腺苷脱氨酶(TadA-8e)和胞嘧啶脱氨酶(hA3A*)分别融合开发出超高活性的微型单碱基编辑器eiABE和eiCBE,最高位编辑效率分别可达到73.6%和79.2%。
此外,先前并没有研究证明IscB在小鼠体内可以产生高效编辑。研究人员首先在小鼠N2a细胞系中针对PCSK9以及Tyr基因进行靶点筛选。测序结果表明eIscB-D在PCSK9-sg29这一靶点可实现58%的编辑效率,在Tyr-sg21靶点的编辑效率为47.1%。研究人员随后通过胚胎注射eIscB-D/eωRNA系统靶向Tyr基因的1号外显子,破坏白化基因的表达,成功制备小鼠白化疾病模型。在F0代,75%(9/12只)突变小鼠实现高效编辑(平均编辑效率为58.8%),其中有5只产生编辑效率接近100%的完全白化表型。该研究首次证明了eIscB-D不仅可以在鼠源细胞系中产生高效编辑,并且可以通过胚胎注射高效制备疾病动物模型。
参考文献
[1] Wong, C. (2023). UK first to approve CRISPR treatment for diseases: what you need to know. Nature 623, 676–677.
[2] Pausch, P., Al-Shayeb, B., Bisom-Rapp, E., Tsuchida, C.A., Li, Z., Cress, B.F., Knott, G.J., Jacobsen, S.E., Banfield, J.F., and Doudna, J.A. (2020). CRISPR-CasΦ from huge phages is a hypercompact genome editor. Science 369, 333-337.
[3] Harrington, L.B., Burstein, D., Chen, J.S., Paez-Espino, D., Ma, E., Witte, I.P., Cofsky, J.C., Kyrpides, N.C., Banfield, J.F., and Doudna, J.A. (2018). Programmed DNA destruction by miniature CRISPR-Cas14 enzymes. Science 362, 839-842.
[4] Chen, W., Ma, J., Wu, Z., Wang, Z., Zhang, H., Fu, W., Pan, D., Shi, J., and Ji, Q. (2023). Cas12n nucleases, early evolutionary intermediates of type V CRISPR, comprise a distinct family of miniature genome editors. Mol. Cell 83, 2768-2780.e2766.
[5] Karvelis, T., Druteika, G., Bigelyte, G., Budre, K., Zedaveinyte, R., Silanskas, A., Kazlauskas, D., Venclovas, Č., and Siksnys, V. (2021). Transposon-associated TnpB is a programmable RNA-guided DNA endonuclease. Nature 599, 692-696.
[6] Xiang, G., Li, Y., Sun, J., Huo, Y., Cao, S., Cao, Y., Guo, Y., Yang, L., Cai, Y., Zhang, Y.E., et al. (2023). Evolutionary mining and functional characterization of TnpB nucleases identify efficient miniature genome editors. Nat. Biotechnol. 42, 745-757.
[7] Saito, M., Xu, P., Faure, G., Maguire, S., Kannan, S., Altae-Tran, H., Vo, S., Desimone, A., Macrae, R.K., and Zhang, F. (2023). Fanzor is a eukaryotic programmable RNA-guided endonuclease. Nature 620, 660-668.
[8] Jiang, K., Lim, J., Sgrizzi, S., Trinh, M., Kayabolen, A., Yutin, N., Bao, W., Kato, K., Koonin, E.V., Gootenberg, J.S., et al. (2023). Programmable RNA-guided DNA endonucleases are widespread in eukaryotes and their viruses. Sci. Adv. 9, eadk0171.
[9] Altae-Tran, H., Kannan, S., Demircioglu, F.E., Oshiro, R., Nety, S.P., McKay, L.J., Dlakić, M., Inskeep, W.P., Makarova, K.S., Macrae, R.K., et al. (2021). The widespread IS200/605 transposon family encodes diverse programmable RNA-guided endonucleases. Science 374, 57-65.
[10] Xu, X., Chemparathy, A., Zeng, L., Kempton, H.R., Shang, S., Nakamura, M., and Qi, L.S. (2021). Engineered miniature CRISPR-Cas system for mammalian genome regulation and editing. Mol. Cell 81, 4333-4345.e4334.
[11] McGaw, C., Garrity, A.J., Munoz, G.Z., Haswell, J.R., Sengupta, S., Keston-Smith, E., Hunnewell, P., Ornstein, A., Bose, M., Wessells, Q., et al. (2022). Engineered Cas12i2 is a versatile high-efficiency platform for therapeutic genome editing. Nat. Commun. 13, 2833.
作者专访
Cell Press细胞出版社公众号特别邀请李大力教授进行了专访,为大家进一步详细解读。
CellPress:
请简要概述该工作的研究目的。
李大力教授:
我们一开始做这项工作还是因为现有的基因编辑工具在体内递送方面面临着尺寸太大的问题。IscB是Cas9进化上的祖先,尺寸不到Cas9的30%,大约400个氨基酸左右,理论上能够装载在单个AAV载体里进行体内递送。但是IscB在哺乳动物细胞中的原始活性太低,不足5%,我们希望能够通过工程化的改造使得它有着跟Cas9相当的活性。
CellPress:
请简要概述该工作的研究意义。
李大力教授:
在这项工作中,我们开发了高活性的eIscB-D/ eωRNA系统,并基于此获得了高效的微型碱基编辑工具(eiABE和eiCBE)。最后,通过胚胎显微注射技术,我们高效地构建了白化小鼠疾病模型。这个结果极大地增加了单个AAV载体安全高效递送微型基因编辑工具的可能性,丰富了基因编辑工具的应用场景,为将来用于体内基因治疗提供了高效的候选技术。
CellPress:
请简要概述该工作存在哪些不足的地方以及未来的研究计划。
李大力教授:
一方面我们通过GUIDE-seq检测发现,IscB会诱发一定的脱靶效应,虽然不是很严重,但是我们当务之急是提高eIscB-D的特异性,保证它的安全性。另一方面,NWRRNA的TAM有一些复杂,我们希望能够解除一些TAM限制,拓宽靶向的范围。后续我们还是希望能够利用单个AAV载体递送碱基编辑器(BE)或者是先导编辑器(PE)在疾病动物模型中评价它的表现,推动小型基因编辑工具的临床应用的发展。

作者介绍

李大力
教授
李大力,华东师范大学生命科学学院二级教授,基金委“杰出青年基金”获得者,上海市基因编辑与细胞治疗前沿科学基地主任,上海市调控生物学重点实验室副主任,华东师范大学闵行实验动物中心主任。建立世界领先的基因编辑疾病模型构建技术体系,开发了一系列高精度和新功能的碱基编辑技术,以血友病和β地中海贫血等单基因血液遗传病为模型,建立了遗传病基因治疗新策略。开展了全球首例基因编辑治疗最严重的β0/β0地中海贫血患者的临床研究,治愈了多名患者;在国际上率先开发了基因编辑定点整合的非病毒导入型CAR-T细胞制品,展现了比慢病毒导入策略更高的疗效和安全性。迄今,共发表SCI论文100余篇,作为通讯作者在Cell Stem Cell、Molecular Cell、Nature、Nature Biotechnology、Nature Genetics、Nature Cell Biology、Nature Medicine、Nature Chemical Biology、Nature Protocols、PNAS和Cell Research等高水平期刊发表论文50余篇。作为首席科学家主持科技部重点研发项目,获国家自然科学基金杰出青年基金和重点项目等基金支持,2018年获教育部高等学校科学研究优秀成果奖(自然科学一等奖,排名第二)、2023年获得第16届谈家桢生命科学创新奖、教育部首届“卓越青年研究生导师奖励基金”。
相关论文信息
论文原文刊载于Cell Press细胞出版社旗下期刊Molecular Cell上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Engineering IscB to develop highly efficient miniature editing tools in mammalian cells and embryos
▌论文网址:
https://www.sciencedirect.com/science/article/abs/pii/S1097276524005835
▌DOI:
https://doi.org/10.1016/j.molcel.2024.07.007
的前身Cell Press Community Review模式于2021年推出。对于通过Cell Press Multi-Journal Submission“多刊审稿”模式投稿的作者,我们将提供稿件被多本期刊同时考虑的机会。超过80%通过Cell Press Multi-Journal Submission“多刊审稿”模式投稿的文章获得了至少一个或多个期刊的评审。
CellPress细胞出版社